حرارة احتراق الوقود(القيمة الحرارية) هي كمية الحرارة المنبعثة أثناء الاحتراق الكامل لجميع المكونات القابلة للاحتراق للوقود ، والمشار إليها بـ 1 كجم من الوقود الصلب أو السائل أو 1 نانومتر 3 (م 3 في الظروف العادية) من الوقود الغازي.
يعتمد التأثير الحراري لاحتراق الوقود على حالة تجميع منتج واحد لاحتراقه - الماء ، لذلك يميزون أعلىسفي و أدنىس n حرارة الاحتراق. إذا قمنا بتكوين تفاعلات الاحتراق لمكونات الوقود بطريقة تجعل الماء المتكون فيها في حالة سائلة ، فإن الحساب سيعطي القيمة سفي. إذا أخذنا في الاعتبار الماء الناتج في حالة بخار ، فإن الحساب سيعطي قيمة القيمة الحرارية سن. تظل حرارة التبخير غير مستخدمة بسبب ارتفاع درجة حرارة غازات العادم ، وبالتالي فإن الغازات الرئيسية عملخصائص الوقود هي أدنى حرارة عمل.
بالنظر إلى أن الحرارة التي يتم إنفاقها على تبخر 1 كجم من الرطوبة هي 2500 كيلو جول ، يتم التعبير عن العلاقة بين قيم السعرات الحرارية الأعلى والأقل بالصيغة:
حرارة احتراق الوقود الصلب والسائل 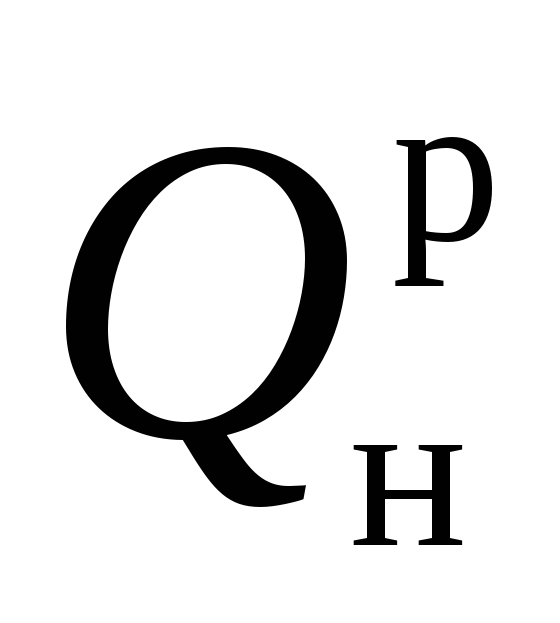 يمكن حسابها بالصيغة D.I. منديليف ، مع العلم بالتركيب الأولي لوقود العمل:
يمكن حسابها بالصيغة D.I. منديليف ، مع العلم بالتركيب الأولي لوقود العمل:
|
|
أين من ص ، ن ص ، حول ص , س ص , دبليو صهي العناصر المكونة للوقود العامل ، الكتلة ٪.
بالنسبة للوقود الغازي ، القيمة الحرارية  يُعرَّف بأنه مجموع نواتج التأثيرات الحرارية لمكونات الغاز القابل للاحتراق وكميتها:
يُعرَّف بأنه مجموع نواتج التأثيرات الحرارية لمكونات الغاز القابل للاحتراق وكميتها:
للغاز الطبيعي
|
1460.8 درجة مئوية 5 ساعات 12 ، كيلوجول / نانومتر 3. |
في هذه الصيغة ، يتم التعبير عن مكونات الوقود الغازي العامل (الرطب) بالحجم٪.
لمقارنة كفاءة أنواع الوقود المختلفة وتحديد استهلاك الوقود المحدد للمعالجة الحرارية لـ 1 كجم من المواد ، استخدم وحدات من الوقود القياسي(الفحم الصلب) ، حيث يفترض أن تكون قيمته الحرارية 29300 كيلو جول / كجم. يتم تحويل أي وقود إلى وحدات وقود قياسية باستخدام المكافئ الحراري (معامل التحويل ه T):
استهلاك هواء الاحتراق
يتم أخذ التركيبة التالية من الهواء الجاف في الاعتبار في الحسابات: نيتروجين - 79.0٪ ، أكسجين - 21.0٪ من حيث الحجم.
مطلوب نظريًا استهلاك الهواء الجاف للاحتراق(إل 0) باستخدام الصيغ التالية:
للوقود الصلب والسائل
للغاز الطبيعي
أين - نسبة الهواء الزائد.
تعتمد القيم الدنيا المسموح بها لـ على نوع الوقود الذي يتم حرقه وطريقة الاحتراق وتصميم أجهزة حرق الوقود وظروف تشغيل الفرن. للغاز وزيت الوقود = 1.05-1.2 ؛ للوقود الصلب المسحوق = 1.20-1.25 ؛ مع احتراق طبقات من الفحم والأنثراسيت والجفت في أفران ميكانيكية مع إمداد مستمر بالوقود وإزالة الرماد = 1.3-1.4. لتقليل درجة حرارة منتجات احتراق الوقود (PGT) بالمقارنة مع درجة الحرارة النظرية ، خذ كبيرالقيم: ما يصل إلى 1.5 أو أكثر.
يزيد بخار الماء الموجود في الهواء الجوي قليلاً من استهلاكه مقارنة بالهواء الجاف. يتم أخذ كمية هذه الرطوبة في الاعتبار باستخدام محتوى الرطوبة في الهواء الجوي ، معبرًا عنه بالكتلة٪. استهلاك الهواء الجوي ( إل د') في محتوى الرطوبة د(جم / كجم هواء جاف) يساوي.
تعتمد حرارة احتراق مادة ما على هيكلها وحالة تجمعها.
وفقًا لقانون هيس: س = ∑ س ل - س حول
س ل - مجموع حرارة احتراق المكونات الموجودة في هذه المادة
س حول - حرارة تكوين مادة معينة في عملية الاحتراق
مثال: ؛
13. تقدير حرارة احتراق خليط الغازات
تُعرَّف حرارة احتراق خليط الغاز على أنها مجموع درجات حرارة احتراق المكونات القابلة للاحتراق
, أين م- عدد الغازات القابلة للاحتراق في الخليط
س م- القيمة الحرارية لمادة M-th القابلة للاحتراق. غاز
م- كمية الغازات القابلة للاحتراق بالجرام.
ح م- مثال النسبة المئوية: بالنسبة لمزيج من H2 وأول أكسيد الكربون والميثان وكبريتيد الهيدروجين ، تكون القيمة الحرارية:
14. تقدير حرارة احتراق مادة معقدة
يمكن تحديده من خلال مجموع حرارة احتراق المكونات الأولية الفردية.
صيغة D. منديليف:
س في - قيمة حرارية أعلى
حول - المحتوى. الأكسجين
يتم تحديد حرارة احتراق مادة قابلة للاحتراق ذات تكوين غير معروف تجريبياً في المسعرات.
يتم حرق كمية معروفة من مادة صلبة أو سائلة أو غازية في المسعر ، ويتم امتصاص الطاقة الحرارية المنبعثة في هذه الحالة بالكامل تقريبًا بواسطة مياه التبريد.
يتم تحديد قيمة حرارة الاحتراق من معادلة توازن الحرارة للمسعر بكمية الماء وزيادة درجة حرارته.
معادلة الاحتراق المتكافئة
؛ أين م ik- عدد الذرات كالعنصر -th في أنا -مركب
ن أنا - رقم أنا عشر جزيئات في الوقود. النظام
في لهو العدد الإجمالي لذرات مادة كيميائية معينة. عنصر في الخليط
معادلة تفاعل الاحتراق بشكل عام:
أين لكن أنا - رمز كيميائي أنا مادة البداية
F أنا - رمز كيميائي يالمادة النهائية
ن منظمة العفو الدولية , ن فج - المعاملات المتكافئة
أنا 0 - كمية مواد البدء
ي 0 - كمية المواد النهائية
يسمى الخليط القابل للاحتراق متكافئ، إذا تم أخذ مواد البداية بمعدل يحولها التحول الكيميائي تمامًا إلى منتجات تفاعل.
نظام تكوين متكافئ قابل للاشتعاليسمى النظام بنظام النسبة بين كمية المؤكسد والوقود اللازم للاحتراق الكامل. يؤدي إلى تكوين منتجات غير قادرة على الاحتراق اللاحق.
لكن 1 - رمز كيميائي لمادة قابلة للاحتراق
لكن 2 - الرمز الكيميائي للعامل المؤكسد
F- الرمز الكيميائي لمنتجات الاحتراق
ن أ 1 - معامل القياس المتكافئ
معامل القياس المتكافئ المحدد لتفاعل الاحتراق:
أين م ج , م س , م ح، ... - عدد ذرات الكربون والكبريت والهيدروجين في جزيء الذرة
م X هو عدد الذرات. الهالوجينات (Cl ، Br ، ...)
15. تحديد استهلاك المؤكسد
يمكن تحديد الاستهلاك المتكافئ للمؤكسد أثناء احتراق مادة قابلة للاحتراق عن طريق تحويل قيمة المعامل المتكافئ المحدد (β) إلى وحدات كتلة أو وحدات حجم.
استهلاك محدد
C ، H ، S ، O - acc. البريد تا في الشيء الخامس
استهلاك الهواء المحدد في القياس المتكافئ للاحتراق:
استهلاك الهواء الفعلي المحدد للاحتراق: α- معامل استهلاك الهواء. معامل في الرياضيات او درجة يوضح معدل تدفق الهواء α نسبة معينة. عمل استهلاك الهواء على وجه التحديد. متكافئ.
بالنسبة لـ α<1 - горит богатая система, α >1 - نظام ضعيف ، α = 1 - خليط من المقاييس المتكافئة. تعبير
يمكن تحديد حرارة الاحتراق بطريقتين. الأول هو القياس المباشر لكمية الحرارة المنبعثة أثناء احتراق كمية معينة من الوقود الذي تم فحصه ، أي مسار تجريبي. تعتمد الطريقة الثانية على حقيقة أن هذه الخاصية تُحسب بناءً على حرارة احتراق المكونات القابلة للاحتراق للوقود ، وبالتالي يتم تحديدها من خلال محتوى الأخير في الوقود. وبالتالي ، في الحالة الثانية ، يلزم معرفة التركيب الدقيق للوقود والتأثيرات الحرارية التي تصاحب تفاعلات الأكسدة للمكونات القابلة للاحتراق.
تقدير حرارة احتراق الوقود حسب التحليل الأولي. نظرًا لأن حرارة احتراق المركب ، وفقًا لقانون Hess ، تساوي الفرق بين حرارة احتراق الكربون والهيدروجين والكبريت وحرارة تكوين الجزيء ، ثم حساب القيمة الحرارية للوقود ، من الضروري معرفة ليس فقط محتوى الكربون والهيدروجين والكبريت فيه ، ولكن أيضًا معرفة طبيعة تلك المركبات التي توجد فيها هذه العناصر في الوقود.
أساس طريقة تحديد القيمة الحرارية المحسوبة لأي وقود هو مفهوم هذه القيمة كمجموع القيم الحرارية للعناصر أو مركباتها الموجودة في الوقود. وبالتالي ، بالنسبة لهذا النوع من الحسابات ، فإن كميات المكونات المختلفة في الوقود (لها التركيب الكيميائي) وحرارة احتراقها.
بالنسبة للوقود من هذه الأنواع ، من خلال تحليل أنه من المستحيل تحديد عدد ونوع مركبات عناصر الكتلة القابلة للاحتراق ، فإن بناء صيغة عقلانية لتحديد القيمة الحرارية يواجه بشكل طبيعي صعوبات لا يمكن التغلب عليها ، ونتيجة لذلك يمكن أن يتحدث فقط عن درجة أكبر أو أقل من التقريب.
في عام 1843 ، بعد خمس سنوات من وفاة الكيميائي الفرنسي الشهير P. Dulong (الأصح Dulon) ، تم نشر مواده الخاصة بحساب حرارة الاحتراق. لقد شكلوا الأساس للعديد من المتغيرات لصيغته ، مبنية على أساس الافتراضات التالية:
1) يرتبط الأكسجين الموجود في الكتلة القابلة للاحتراق للوقود تمامًا بالهيدروجين ؛
2) أثناء احتراق الهيدروجين في الماء (بدون تبخر) ، غير المرتبط بالأكسجين ، أو ما يسمى بالهيدروجين الحر ، يتم إطلاق نفس كمية الحرارة أثناء احتراق الهيدروجين الجزيئي الغازي ؛
3) يعتبر الوقود مزيجًا ميكانيكيًا من الكربون والهيدروجين الحر والكبريت القابل للاشتعال ، ولا تؤخذ حرارة التحلل الجزيئي في الاعتبار.
تم تصميم صيغة Dulong لحساب القيمة الحرارية الإجمالية. لحساب القيمة الحرارية الصافية ، اقترح Bunte في عام 1891 معادلة تختلف عن صيغة Dulong من حيث أنها تأخذ في الاعتبار استهلاك الحرارة لتبخر الماء المتكون أثناء احتراق الهيدروجين الحر والرطوبة الموجودة في الوقود (حوالي 2.51) MJ لكل 1 كجم من الرطوبة). صيغة جمعية المهندسين الألمان (1899) قريبة من صيغة Bunte. في شكل معدل قليلاً ، لا تزال صيغ Bunte وجمعية المهندسين الألمان مستخدمة على نطاق واسع في البلدان أوروبا الغربية. شوستر يعطي صيغ Dulong وجمعية المهندسين الألمان الشكل التالي
MJ / كجم ؛ (2.1)
MJ / كجم. (2.2)
هذه الصيغ مناسبة لحساب القيمة الحرارية فقط للفحم وتؤدي إلى خطأ جسيم في تحديد القيمة الحرارية لأنواع الوقود الأخرى.
أصبح D.I Mendeleev ، الذي درس خصائص الوقود ، مقتنعًا بعدم دقة الصيغ المقترحة ومغالطة العديد من الأحكام المقبولة. أولاً ، حرارة احتراق الهيدروجين الموجودة في المركبات العضوية المعقدة التي تتشكل وقود صلب، يساوي حرارة احتراق الهيدروجين الغازي الجزيئي - حوالي 142.4 ميجا جول / كجم. ثانيًا ، من غير المعقول تمامًا أن يتم التعرف على كل الأكسجين الموجود في الكتلة القابلة للاحتراق للوقود على أنه في رابطة كيميائية مع الهيدروجين.
الاعتراض الرئيسي على التطبيق العام لهذه الصيغة هو أنها "تمثل الوقود كمزيج ميكانيكي من الهيدروكربونات القابلة للاحتراق والهيدروجين والماء غير القابل للاحتراق ، دون مراعاة حقيقة أن الحرارة تنطلق أو تمتص أثناء تكوين أي مركب كيميائي ، وبالتالي ، أثناء احتراق المركبات الكيميائية لا يمكن أن تطلق قدرًا كبيرًا من الحرارة مثل احتراق المكونات التي يمكن أن تتكون منها. علاوة على ذلك ، فإن الفرضية حول محتوى كل الأكسجين في الوقود على شكل ماء لا تستند إلى أي شيء.
شرع DIMendeleev في تطوير صيغة عالمية مناسبة لحساب حرارة احتراق جميع أنواع الوقود الصلب والسائل. تم التعرف على حرارة احتراق الهيدروجين ، وهو جزء من المركبات العضوية للوقود الصلب والسائل ، من قبل DI Mendeleev على أنها أقل من حرارة الهيدروجين الجزيئي الغازي ، ولا تساوي 142.4 MJ / kg ، ولكن إلى 125.6 MJ / kg . بالإضافة إلى ذلك ، كان يعتقد أن الأكسجين في تركيبة كيميائية ليس فقط مع الهيدروجين ، ولكن أيضًا مع الكربون. وفقًا لذلك ، اعتبر أنه من الضروري التخلي عن مفهوم الهيدروجين الحر أو "القابل للاحتراق" وحساب حرارة احتراق الوقود ، بناءً على محتوى الكمية الكاملة للهيدروجين في كتلته القابلة للاحتراق.
الانخفاض في حرارة الاحتراق بسبب محتوى الأكسجين في الكتلة القابلة للاحتراق ، حسب DI Mendeleev على أساس حرارة احتراق عدد من الوقود بمحتوى أكسجين مختلف ، اتضح أنه يساوي 10.9 MJ لكل 1 كيلوغرام من الأكسجين ، أي 108.5 كيلو جول لكل نسبة مئوية من محتواها في الكتلة القابلة للاحتراق. لحساب القيمة الحرارية العالية للوقود ، اقترح DI Mendeleev معادلة بسيطة للغاية:
MJ / كجم. (2.3)
تم التحقق من قابلية تطبيق هذه الصيغة بواسطة D.I. Mendeleev من خلال حساب تكوين حرارة الاحتراق أنواع مختلفةالوقود ، وهي: الكربون والألياف والفحم والمنتجات النفطية ، وحرارة الاحتراق التي تم تحديدها بالطريقة المسعرية ، ونتيجة لذلك توصل إلى استنتاج مفاده أن الصيغة المقترحة تعطي تطابقًا دقيقًا إلى حد ما مع نتائج التحديدات الحرارية. أنواع مختلفة من الوقود. أعلن D.I. Mendeleev عن صيغته في 6 فبراير 1897 في اجتماع لقسم الكيمياء في الجمعية الفيزيائية والكيميائية الروسية. تم نشره في نفس العام.
للوهلة الأولى ، قد يبدو أن صيغة Mendeleev لا تأخذ في الاعتبار محتوى الصابورة في الوقود ، أي الرطوبة والمعادن والنيتروجين. في الواقع ، هذا ليس كذلك. يؤثر محتوى الصابورة في الوقود على انخفاض حرارة احتراق الوقود المحسوبة وفقًا لصيغة D.I. Mendeleev نتيجة لانخفاض مماثل في محتوى المكونات القابلة للاحتراق.
عند حساب صافي القيمة الحرارية للوقود ، أي مع الأخذ في الاعتبار الحرارة التي يتم إنفاقها على تبخر الماء ، والتي تكونت أثناء احتراق الهيدروجين والموجودة في الوقود ، فإن صيغة D.I. Mendeleev تأخذ الشكل التالي
ميجا جول / كجم ، (2.4)
MJ / كجم. (2.5)
حساب حرارة احتراق الوقود الغازي من خلال تكوين المكونات. تُحسب القيم الحرارية العالية والمنخفضة للوقود الغازي على أساس تفاعلات الأكسدة للمكونات والحرارة القياسية لتكوين المواد وفقًا للصيغ:
0.126 CO + 0.128 H 2 + 0.398 CH 4 + 0.695 C 2 H 6 + 0.992 C 3 H 8 +
1.285 C 4 H 10 + 1.578 C 5 H 12 + 0.628 C 2 H 4 + 0.921 C 3 H 6 + 1.214 C 4 H 8 +
1.507 C 5 H 10 + 1.465 C 6 H 6 + 0.255 H 2 S MJ / م 3. (2.6)
0.126 CO + 0.108 H 2 + 0.358 CH 4 + 0.636 C 2 H 6 + 0.913 C 3 H 8 +
1.206 C 4 H 10 + 1.461 C 5 H 12 + 0.590 C 2 H 4 + 0.858 C 3 H 6 + 1.135 C 4 H 8 +
1.411 C 5 H 10 + 1.403 C 6 H 6 + 0.234 H 2 S MJ / م 3. (2.7)
بالنسبة لغازات حقول النفط الطبيعية والمرتبطة بها والتي تحتوي على نسبة عالية من الميثان ، بما في ذلك ، بالإضافة إلى الميثان ، متماثلاتها ، وكذلك ثاني أكسيد الكربون وكبريتيد الهيدروجين والنيتروجين ، يمكن حساب صافي القيمة الحرارية باستخدام الصيغة ذات المعاملات المقربة:
0.358 CH 4 + 0.628 C 2 H 6 + 0.921 C 3 H 8 + 1.172 C 4 H 10 +
1.465 C 5 H 12 + 0.251 H 2 S MJ / م 3. (2.8)
3. حسابات احتراق الوقود
الغرض من الحسابات هو تحديد المؤشرات التي تميز ظروف حرق الوقود لتركيبة معينة ، وكمية وتكوين منتجات الاحتراق الناتجة ، ودرجة حرارة الاحتراق (سعة التسخين) للوقود ، إلخ.
يمكن إجراء جميع الحسابات لتحديد الكميات المدرجة وفقًا للتحليل الأولي للمواد المتضمنة في عملية الاحتراق بناءً على النسب المتكافئة للمعادلات الكيميائية المقابلة. على سبيل المثال ، المعادلة
C + O 2 \ u003d CO 2 + ∆ ح ص
بالإضافة إلى الوصف النوعي لعملية الاحتراق ، فإنه يعطي وصفًا كميًا صارمًا لها.
استنادًا إلى القوانين المتعلقة بثبات العلاقات الجماعية ، وقانون هيس بشأن استقلال التأثير الحراري لتفاعل من مسار تنفيذه والعمليات الوسيطة ، وقوانين حفظ المادة والطاقة ، يمكن القول بأن تكوين يتطلب 1 مول (44 جم) من ثاني أكسيد الكربون استهلاك 1 مول (12 جم) من الكربون و 1 مول (16 جم) من الأكسجين. وترافق العملية إطلاق حرارة بكمية 97650 كالوري.
المعادلات المماثلة التي تصف عملية أكسدة العناصر الفردية (المكونات) للوقود هي أساس طريقة حساب الخصائص المذكورة أعلاه.
 \ u003d 358.2 CH 4 + 637.5 C 2 H 6 + 912.5 C 3 H 8 + 1186.5 C 4 H 10 +
\ u003d 358.2 CH 4 + 637.5 C 2 H 6 + 912.5 C 3 H 8 + 1186.5 C 4 H 10 +