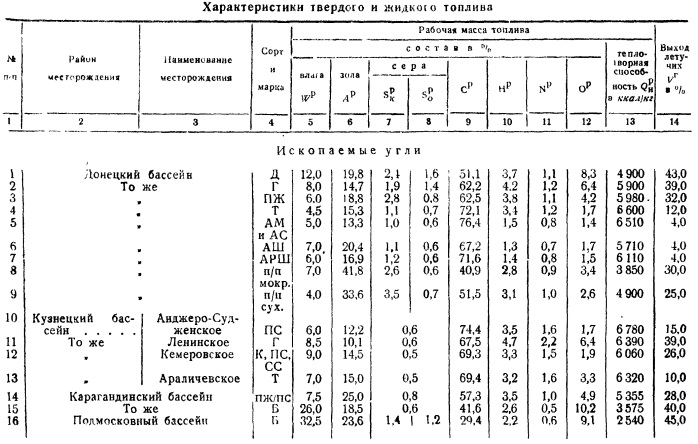
Kot smo že omenili, so gorljivi elementi v gorivu ogljik C, vodik H in hlapno gorljivo žveplo S. Osnovno zgorevanje lahko predstavimo z naslednjimi enačbami:
C+02 = C02; 2H 2 +0 2 \u003d 2H 2 0; S+0 2 =S0 2 . (6)
V procesu zgorevanja gorljivih elementov se pri zgorevanju 1 kg sprosti gorivo:
ogljik - 7854 kcal/kg
vodik - 34180 (odvisno od tvorbe vode, ne vodne pare, sicer - 28905 kcal / kg)
Če predpostavimo, da so elementi, ki sestavljajo gorivo, v njem v obliki mehanske mešanice, potem lahko kalorično vrednost goriva izračunamo kot vsoto na podlagi informacij o zgorevanju gorljivih elementov.
Vendar pa določanje kurilne vrednosti s takšnimi metodami daje znatno neskladje z dejansko kurilno vrednostjo, določeno s kalorimetrično metodo. To je posledica dejstva, da goriva ni mogoče obravnavati kot mehansko mešanico posameznih elementov. Molekule goriva imajo zelo zapleteno strukturo in v procesu zgorevanja pride do kemičnega razpada molekul s porabo toplote za te procese.
Torej, če poznamo elementarno sestavo goriva, lahko njegovo kurilno vrednost določimo le približno z empiričnimi formulami; od teh najbolj natančen pripada D. I. Mendelejevu in je izražen takole:
Q r in \u003d 81C P + 300H P - 26 (O r - S r l) kcal / kg. (7)
Neposredno določanje kurilne vrednosti se izvede s sežiganjem vzorca goriva v atmosferi kisika. Za te namene se uporablja tako imenovana kalorimetrična bomba, ki je posoda z debelimi stenami, v katero se da gorivo in se črpa kisik do tlaka 25-30 atm.
Bomba (slika b) ima kapaciteto približno 300 cmg in je izdelana iz kislinsko odpornega jekla. V pokrovu bombe so ventili za dovajanje kisika in sproščanje zgorelih plinov. Kisik se dovaja skozi cev na dno bombe; plini se odstranijo od zgoraj. Na pokrov bombe je priključena palica, na katero je pritrjena platinasta ali kremenova skodelica, vanjo je nameščen vzorec. trdo gorivo ali nalijte tekočino. Oblikujeta se palica in cev, ki dovajata kisik električni tokokrog z gorivom, palica pa je električno izolirana od telesa bombe. Skozi tokokrog poteka električni tok. Tokokrog je zaprt s tanko jekleno žico.
Vzorec trdega goriva je vzet enak 0,8-1,5 g, tekočega - 0,6-0,8 g. Iz vzorca trdega goriva se pogosto oblikuje briket, v katerega se v vžigalno žico stisne zapiralna mreža, ki ob prehodu gori. to električni tok napetost 12-15 V. Žica, ki gori, zažge vzorec goriva. Nebriketna goriva (antracit, pusto premog, skrilavec, žariščni ostanki) se sežigajo v obliki prahu. Žica za vžig je upognjena tako, da je v stiku z gorivom (trdo gorivo v prahu ali tekoče gorivo).
Bomba je potopljena v posodo, napolnjeno z vodo in prostornino 2000-2500 cm 3 . Ta kalorimeter pa je nameščen v kovinskem ohišju z dvojnimi stenami, med katerimi je prostor napolnjen z vodo. To ohišje v veliki meri ščiti kalorimeter pred izmenjavo toplote z okoljem.
Kalorimeter je opremljen s posebnimi mešali, ki jih poganja elektromotor in se uporabljajo za izenačevanje temperature vode.
Prostor za kalorimetrijo naj bo izoliran, okna naj bodo obrnjena čim bolj proti severu, da se prepreči izpostavljenost sončnim žarkom.
Ko se v bombo vstavi vzorec goriva in vstopi kisik s tlakom do 25-30 atm, se skozi električni tokokrog spusti tok, žica za vžig in vzorec izgori.
Sproščena toplota segreje vodo kalorimetra; povišanje temperature vode opazi poseben termometer z natančnostjo 0,001 °.
Delitve termometra gledamo skozi optično cev, ki je trdno pritrjena na stojalo, kar izključuje možnost znanih posameznih napak pri določanju stojala živega srebra.
V gorivu in v jeklenki s kisikom, od koder slednji vstopi v bombo, je določena količina dušika, ki prispeva k tvorbi dušikove kisline v bombi; na enak način hlapno žveplo v prisotnosti vode gori v žveplovo kislino. Nastajanje teh kislin spremlja sproščanje toplote, ki jo je treba izračunati in odšteti od nastale kurilne vrednosti, saj takšne kisline v operativni praksi zgorevanja goriva ne nastajajo. Vodo, ki tvori kisline, dobimo v bombi zaradi kondenzacije vodne pare; za popolno raztapljanje kislin v bombo vlijemo 10 cm 3 destilirane vode.
Med zgorevanjem vzorca goriva toploto ne absorbira le voda kalorimetra, temveč tudi celotna naprava, ki jo sestavljajo kalorimetrična posoda z vlito vodo, mešalo, termometer in bomba z njeno vsebino. Toplotne kapacitete posameznih delov so različne, zato se bomba predhodno kalibrira tako, da se v njej sežge snov, katere kalorična vrednost je natančno znana in se ne spreminja. V tem poskusu se določi vodni ekvivalent bombe, to pomeni, da se toplotna absorpcija vseh naštetih delov naprave nadomesti s toplotno absorpcijo ekvivalentne teže vode. Vzorec benzojske kisline se običajno uporablja kot snov, ki se zgoreva med kalibracijo.
Kalorimeter, ki je v prostoru, tudi brez zgorevanja goriva, bo odvisno od temperaturnih pogojev dajal ali prejemal toploto okolje. Zato temperaturna razlika, ugotovljena v intervalu od začetka zgorevanja do konca dviga temperature vode v kalorimetru, še ne bo označevala kalorične vrednosti goriva. Treba je uvesti popravek za izmenjavo toplote naprave z okoljem, saj bi v tem času lahko oddajala ali prejemala toploto. S sistematičnim beleženjem temperature vode nekaj časa pred poskusom, med poskusom in po njem lahko dobimo ta popravek. Korekcija se določi na podlagi določitve velikosti spremembe temperature vode v kalorimetru samo zaradi izpostavljenosti okolju. Če poznamo težo žice za vžig in njeno kalorično vrednost, je mogoče narediti popravek za gorenje žice.
Posledično se kurilna vrednost goriva za bombo določi z naslednjo formulo:
Q b \u003d K [(t n + h) - (t o + h o) + Δt] - ∑qv / a (8)
pri čemer je Q b kalorična vrednost bombe za analizo v cal/g;
a je teža vzorca goriva v g;
K je vodni ekvivalent kalorimetra v g;
t n - končna temperatura vode po zgorevanju vzorca v stopinjah;
t o - začetna temperatura vode pred gorenjem v stopinjah;
h in h o sta popravki odčitkov termometra (glede na kalibracijske tabele) v stopinjah;
b teža žice za vžig v g;
q je toplota zgorevanja varovalke; sprejeto: za jekleno žico - 1600 cal / g, za nikelj - 775 cal / g, za papir za šivanje - 4000 cal / g;
∑qv - vsota toplote zgorevanja varovalke pri uporabi žice z navojem v blatu;
Δt - popravek za toplotno izmenjavo naprave z okoljem v stopinjah.
Dušik vstopi v kalorimetrično bombo skupaj s kisikom iz jeklenke, pa tudi iz vzorca goriva. Kot posledica oksidacije dušika s kisikom v prisotnosti vode nastane dušikova kislina.
Na podlagi rezultatov dolgoletnih poskusov je A. I. Karelin predlagal naslednjo empirično formulo za popravek tvorbe dušikove kisline pod danimi pogoji:
Q N = 0,0015Q 6 cal / g. (devet)
Spremembo je odobril ustrezni GOST.
Pri zgorevanju gorljivega žvepla v gorivu nastane SO 2, v prisotnosti vode pa žveplova kislina H 2 S0 4. Za vsak gram hlapnega žvepla v gorivu se pri tvorbi žveplove kisline sprosti 2250 cal ali 1 % -22,5 cal. Tako lahko popravek za tvorbo žveplove kisline izrazimo kot:
Qs=22,5S l cal/g (10)
Če odštejemo od vrednosti kurilne vrednosti, pridobljene iz bombe, stroškov toplote za tvorbo kislin, se kurilna vrednost goriva določi glede na tako imenovano zgornjo mejo:
Q in \u003d Q b - 0,0015Q b - 22,5S l cal / g. (enajst)
Če je bila določena kurilna vrednost delovnega goriva, potem lahko pišete
Q p b \u003d Q p b - 0,0015Q p b -22,5 S p l kcal / kg. (12)
Pri eksperimentalnem določanju kalorične vrednosti goriva s kalorimetrijo se vodna para, ki nastane pri reakciji zgorevanja, kondenzira na relativno hladnih stenah bombe in vrača latentno toploto izhlapevanja. Zato bo kurilna vrednost goriva, določena v kalorimetrični bombi, višja od količine toplote, ki jo je mogoče realizirati v praktičnih pogojih zgorevanja goriva v pečeh kotlov ali peči.
Razmerje med kurilno vrednostjo na najvišji in najnižji meji, ob upoštevanju izgube latentne toplote izhlapevanja, lahko določimo na naslednji način.
Masno količino vodne pare, ki nastane kot posledica zgorevanja vodika, izračunamo tako, da pomnožimo težo vodika v 1 kg goriva (H p /100) [glej. formula (1)], za 9, saj pri zgorevanju 1 kg vodika nastane 9 kg vode. Ta se prišteje k masi vode (W p /100), ki je v gorivu in izhlapi med njegovim zgorevanjem. Številčno vrednost latentne toplote izhlapevanja je treba upoštevati ob upoštevanju parcialnega tlaka vodne pare v izpušnih plinih in je zaokrožena na 600 kcal/kg.
Kalorična vrednost delovno gorivo je določeno s formulo
Q p n \u003d Q p b -600 (9H p + W p / 100) \u003d Q p b -6 (9H p + W p) kcal / kg. (13)
Kalorično vrednost plinastega goriva je mogoče določiti tudi v bombi, vendar se tehnično izkaže, da je ta metoda zapletena, za raziskave pa se pogosto uporabljajo kalorimetri, posebej prilagojeni za izgorevanje plina.
Medsebojna pretvorba kalorične vrednosti ene sestave goriva v drugo poteka podobno kot pretvorba elementarne sestave, le da je treba upoštevati porabo toplote za izhlapevanje vode.

![]()
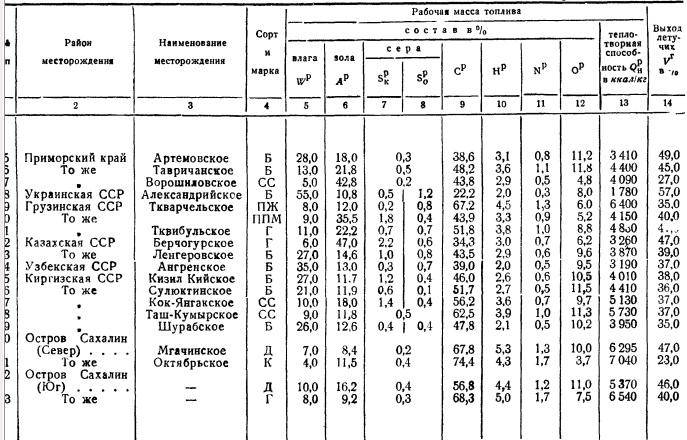
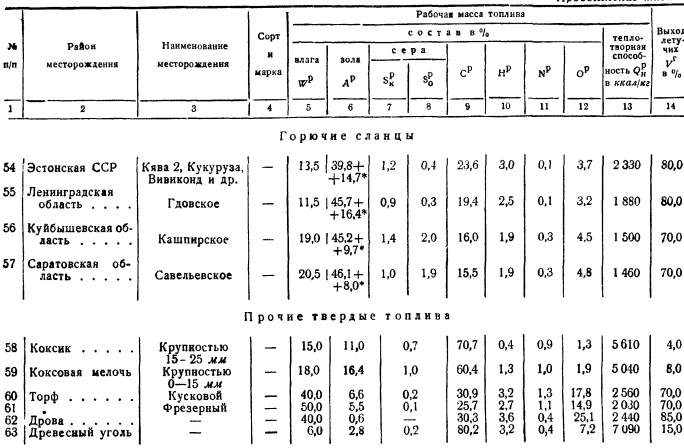
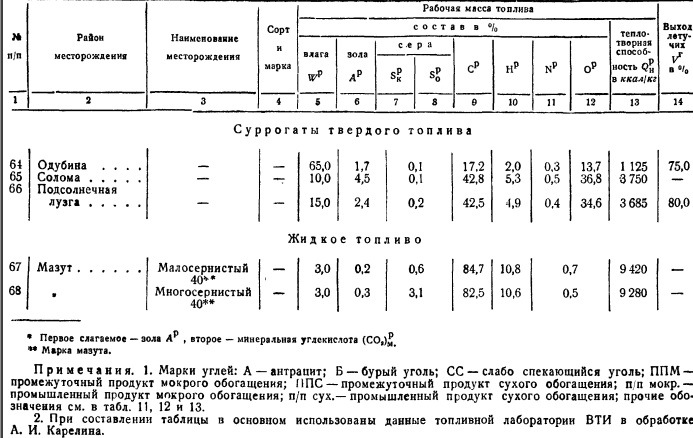
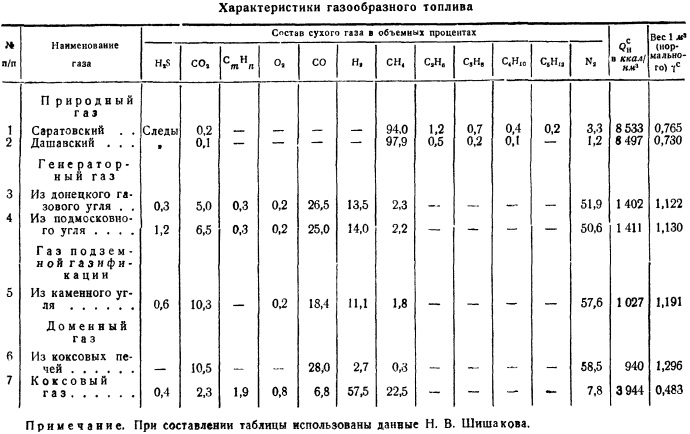
kalorimetrična bomba. Metode za odvzem povprečnega vzorca goriva bodo podrobneje obravnavane v § 6. Upoštevati je treba le, da je sestava večine goriv zelo spremenljiva tudi za isto rudarsko mesto, premogovnik, rudnik, močvirje itd., Za karakterizacijo nahajališča goriva je potrebno opraviti številne študije povprečnih vzorcev in jih uporabiti za presojo nekaterih povprečnih številk za sestavo goriva, kalorično vrednost njegove gorljive mase itd. Ta material ima kemično gorivo laboratoriji, katerih sistematizacijo je doslej izvajal le laboratorij VTI, ki občasno objavlja kvalitativne značilnosti goriv. Na podlagi teh podatkov je tabela. 2, ki prikazuje sestavo delovne mase z značilnimi povprečnimi števili onesnaženosti s pepelom in vlago. Neto kalorična vrednost je podana za te povprečne pogoje.
Če je treba za dane pogoje vzeti zunanji balast goriva (pepel in vlaga) drugačen od povprečja, potem je enostavno preračunati najprej za gorljivo maso, nato pa za nove pogoje.
Pri načrtovanju lahko vzamete sestavo in kalorično vrednost v skladu s tabelo. 2. Pri eksperimentiranju se vzame povprečen vzorec in se nato pregleda v kemijskem laboratoriju, kjer se določi tako elementarna sestava goriva kot njegova kurilna vrednost.
količina toplote v kalorijah, ki jih ustvari 1 kg trdno ali tekoče gorivo ali 1 m3 plina med zgorevanjem. T. s. t. se določi v posebnih napravah, imenovanih. kalorimetrične bombe in kalorimetri. Pri zgorevanju goriva v teh napravah se vodna para, ki nastane pri zgorevanju, spravi v tekoče stanje in pri kondenzaciji popolnoma odda svojo toploto. Medtem pa v toplotnih inštalacijah zaradi dejstva, da je temperatura izpušnih plinov vedno višja od temperature kondenzacije, voda, ki nastane pri zgorevanju, ostane v parnem stanju in zato toplota izhlapevanja, ki jo vsebuje toplota zgorevanja, ne more uporabiti. Torej. arr., za praktične namene je toplota zgorevanja bolj okvirna brez upoštevanja toplote izhlapevanja ali, natančneje, toplote kondenzacije vode. Ta toplota, v nasprotju s toploto zgorevanja, pridobljeno v kalorimetrični bombi (višji T. s. t.), se imenuje. nižji T. s. T.; je enako najvišji minus 600 (9 H+W)/100, kjer in W- odstotek vodika in vlage v določenem gorivu. V Združenih državah Amerike je v vse izračune uveden najvišji T. s. t., v ZSSR in zahodni Evropi - najnižja; v zadnjem času pa se kaže trend v prid prehodu na višje T. s. T.
Tehnični železniški slovar. - M.: Državna prometna železniška založba. N. N. Vasiliev, O. N. Isaakyan, N. O. Roginsky, Ya. B. Smolyansky, V. A. Sokovič, T. S. Khachaturov. 1941 .
Poglejte, kaj je "ZDRAVSTVENA ZMOŽNOST GORIVA" v drugih slovarjih:
Količina toplote, ki se sprosti med zgorevanjem 1 kg. trdna ali 1 kubični meter plinasto gorivo. Kalorična vrednost posamezne vrste goriva je odvisna od: njegovih gorljivih sestavin: ogljika, vodika, hlapnega gorljivega žvepla itd.; pa tudi zaradi njegove vsebnosti pepela in ... ... Finančni besednjak
kalorična vrednost goriva- — [Ya.N. Luginsky, M.S. Fezi Zhilinskaya, Yu.S. Kabirov. Angleško ruski slovar elektrotehnike in energetike, Moskva, 1999] Teme elektrotehnike, osnovni pojmi EN učinkovitost porabe goriva ...
kalorična vrednost goriva- 34 kalorična vrednost goriva: skupna količina energije, ki jo ima gorivo, ki jo sprošča pod reguliranimi pogoji. Opomba Kalorična vrednost goriva je izražena v megadžulih na kilogram (MJ / kg), v megadžulih na ... ...
- ... Wikipedia
neto kalorično vrednost goriva, uporabljenega za dodatno ogrevanje- - [A.S. Goldberg. Angleško ruski energetski slovar. 2006] Teme energija na splošno EN neto kalorična vrednost goriva za dodatno ogrevanjeCVnet … Priročnik tehničnega prevajalca
Količina toplote, zmanjšana na enoto teže prostornine goriva, ki se sprosti med zgorevanjem pri stalnem tlaku 101320 Pa v kisiku in hlajenju produktov zgorevanja na temperaturo okolice. Opombe 1. Ta vrednost vsebuje skrito ... ... Priročnik tehničnega prevajalca
bruto kalorična vrednost goriva- 3.1.5 bruto kalorična vrednost goriva (bruto kalorična vrednost): Količina toplote, zmanjšana na enoto teže volumna goriva, ki se sprosti med zgorevanjem pri stalnem tlaku 101320 Pa v kisiku in hlajenju produktov zgorevanja na .. .... Slovar-priročnik izrazov normativne in tehnične dokumentacije
kalorična vrednost- 3.1.1 kalorična vrednost V tem standardu je kalorična vrednost izražena v joulih na 1 kg (J / kg). ... ... Slovar-priročnik izrazov normativne in tehnične dokumentacije
TOPLOTNA KAPACITET, sposobnost ustvarjanja toplote. Kalorična vrednost je osnova za delovanje katerega koli toplotnega motorja. Toplota, ki se sprosti med zgorevanjem goriva, se pretvori v koristno energijo, na primer premika bate lokomotive ... ... Znanstveni in tehnični enciklopedični slovar
Kalorična vrednost ogljikovodikov- skupna količina energije, ki jo imajo naravna ogljikovodikova goriva, ki jo sproščajo pod reguliranimi pogoji ...
Najpogostejši kemične reakcije ki se uporabljajo za proizvodnjo toplote so reakcije zgorevanja. Energija, ki se sprosti med zgorevanjem goriva ali hrane, se imenuje kalorična vrednost(kalorij Ker so vse reakcije zgorevanja eksotermne, je običajno, da se kurilna vrednost navede brez negativnega predznaka. Ker so goriva in hrana običajno mešanice, je njihova kalorična vrednost navedena na gram in ne na mol. Na primer, kalorična vrednost oktana C 8 H 18, ene od sestavin bencina, je toplota, ki se sprosti med zgorevanjem 1 g te snovi:
2C 8 H 18 (l.) + 25O 2 (g.) → 16CO 2 (g.) + 18H 2 O (g.) (1.17)
Upoštevajte, da se v tej reakciji voda, ki je eden od produktov, šteje za plinasto snov. Dejstvo je, da mora v pogojih zgorevanja oktana voda izhlapeti. Sprememba entalpije dane reakcije = - 10920 kJ. Ker ima vsak mol C 8 H 18 maso 114 g, je kalorična vrednost oktana 47,9 kJ / g:
(10920 kJ / 2 mol C 8 H 18) × (1 mol C 8 H 18 / 114 g C 8 H 18) \u003d 47,9 kJ / g C 8 H 18
Po prvem zakonu termodinamike kalorična vrednost katere koli snovi ne bi smela biti odvisna od tega, kako in kje reagira, pod pogojem, da reakcijski produkti ostanejo nespremenjeni. Zato se bombni kalorimeter pogosto uporablja za merjenje kalorične vrednosti (kalorične vsebnosti) živil. Nedvomno je ta metoda veliko enostavnejša od merjenja količine toplote, ki se sprosti v avtomobilskem motorju ali v našem telesu.
KALORIJE HRANE
Večina energije, ki jo potrebuje naše telo, izvira iz ogljikovih hidratov in maščob. V procesu prebave se ogljikovi hidrati razgradijo v glukozo C 6 H 12 O 6. Glukoza je topna v krvi in jo pogosto imenujemo krvni sladkor. S krvnim obtokom se prenaša v celice telesa, kjer v več fazah reagira z O 2 in se sčasoma spremeni v CO 2 (g.) in H 2 O (l.) s sproščanjem energije:
C 6 H 12 O 6 (tv.) + 6O 2 (g.) → 6CO 2 (g.) + 6H 2 O (l.) \u003d - 2816 kJ
Razgradnja ogljikovih hidratov poteka hitro, zato njihova energija takoj vstopi v telo. Vendar shranjuje zelo majhno količino ogljikovih hidratov. Povprečna vsebnost kalorij v ogljikovih hidratih je 17 kJ / g (4 kcal / g).
Tako kot ogljikovi hidrati se tudi maščobe zaradi presnove pretvorijo v CO 2 in H 2 O (dajo enake produkte, ko se izgorejo v kalorimetrični bombi). Na primer, zgorevanje tipičnega maščobnega stearina C 57 H 110 O 6 poteka po enačbi:
2C 57 H 110 O 6 (trdno) + 163O 2 (g.) → 114CO 2 (g.) + 110H 2 O (l.)
= - 75520 kJ
Kemična energija hrane, ki se ne uporablja za vzdrževanje telesne temperature ali mišične aktivnosti ali končno za preureditev atomov hrane v telesne celice, je v njej shranjena v obliki maščob.
TABELA 1.3
Vsebnost kalorij in sestava nekaterih običajnih izdelkov
| živilski izdelek | približna sestava, % | kalorij | |||
| veverice | maščobe | Ogljikovi hidrati | kJ/g | kcal/g | |
| Zeleni grah | 1,9 | - | 7,0 | 1,5 | 0,38 |
| arašidi | 5,5 | ||||
| mleko | 3,3 | 4,0 | 5,0 | 3,0 | 0,74 |
| Pivo* | 0,3 | 1,2 | 1,8 | 0,42 | |
| Fudge (kremast) | 4,4 | ||||
| klobase | - | 3,6 | |||
| sir (cheddar) | 4,7 | ||||
| kruh (bel) | 2,8 | ||||
| jabolka (sveža) | 0,4 | 0,5 | 2,5 | 0,59 | |
| jajca | 0,7 | 1,4 | |||
| * Pivo običajno vsebuje 3,5 % etanola, ki ima visoko vsebnost kalorij. |
Obstajata vsaj dva razloga, zakaj so maščobe priročne za shranjevanje odvečne energije v telesu: 1) so netopne v vodi, kar omogoča njihovo kopičenje v telesu; 2) maščobe sprostijo več energije na gram kot beljakovine ali ogljikovi hidrati, zaradi česar so najučinkovitejši vir energije. Povprečna vsebnost kalorij v maščobah je 38 kJ / g (9 kcal / g).
Presnova beljakovin v telesu povzroči sproščanje manj energije kot pri zgorevanju v kalorimetrični bombi, ker dajejo različne produkte reakcije. Beljakovine vsebujejo dušik, ki se v bombnem kalorimetru sprosti kot N 2 . Ta dušik se iz telesa izloča predvsem v obliki sečnine CH 4 N 2 O. Beljakovine telo uporablja predvsem kot gradbeni material za celične stene različnih organov, kože, las, mišic itd. V povprečju se pri presnovi beljakovin sprosti 17 kJ/g (4 kcal/g).
Vsebnost kalorij nekaterih najpogostejših izdelkov je prikazana v tabeli. 1.3.
VAJA 1.10
Ocenjuje se, da povprečna tekaška oseba porabi 100 kalorij energije na 1 km. Koliko klobas ima vsebnost kalorij, ki vam omogoča, da pretečete 3 km?
rešitev: Ne pozabite, da je kalorija hrane enaka 1 kcal. 3 km tek zahteva porabo energije 300 kalorij, t.j. 300 kcal. Zahtevano število klobas = 300 kcal (1 g klobas / 3,6 kcal) = 83 g klobas. Tako je za tek na 3 km več kot dovolj pojesti 100 g klobas.
Potreba po energiji je močno odvisna od dejavnikov, kot so telesna teža, starost in mišična aktivnost. V povprečju potrebuje odrasla oseba približno 6300 kJ (1500 kcal) na dan, če počiva v toplem prostoru. Pri izvajanju dela srednje intenzivnosti se potrebe po energiji povečajo na približno 10000-13000 kJ (2500-3000 kcal) na dan. To približno ustreza količini energije, ki jo porabi 100-vatna žarnica v 24 urah.
TOPLOTNA KAPACITET GORIVA
V tabeli. 1.4 primerjave značilnosti različne vrste goriva. Upoštevajte, da se kurilna vrednost goriv povečuje z relativno vsebnostjo ogljika ali vodika v njih. Na primer, kurilna vrednost bituminoznega premoga je višja kot pri lesu, ker premog vsebuje več ogljika.
Imenuje se premog, nafta in zemeljski plin, ki so trenutno naši glavni viri energije gorljivi minerali. Domnevajo, da so nastali pred milijoni let kot posledica razkroja rastlin in živali. Vsi se trenutno porabijo veliko hitreje kot njihovo nadaljnje kopičenje. Zemeljski plin je sestavljen iz plinastih ogljikovodikov (spojine ogljika in vodika). Sestava zemeljski plin se razlikuje, vendar večinoma vsebuje metan CH 4 z majhnimi dodatki etana C 2 H 6 , propana C 3 H 8 in butana C 4 H 10 . olje je tekoča mešanica več sto različnih spojin. Večina jih je ogljikovodikov, ostalo pa so predvsem organske spojine, ki vsebujejo žveplo, dušik ali kisik. Premog je trdna snov, ki vsebuje ogljikovodike z veliko molekulsko maso, pa tudi spojine žvepla, kisika in dušika. Prisotnost žvepla v premogu in nafti ima velik pomen ko razpravljamo o problemu onesnaženosti zraka.
TABELA 1.4
Kalorična vrednost in sestava nekaterih običajnih goriv
Vodik H 2 je zelo obetavno gorivo, saj ima zelo visoko kalorično vrednost in pri zgorevanju nastane le voda, zato je "čisto" gorivo, ki ne povzroča onesnaževanja zraka. Vendar pa njegovo široko uporabo kot energenta ovira dejstvo, da narava vsebuje premalo H 2 v prosti obliki. Večina vodika nastane z razgradnjo vode ali ogljikovodikov. Takšna razgradnja zahteva porabo energije, v praksi pa je treba zaradi toplotnih izgub za proizvodnjo vodika porabiti več energije, kot jo je mogoče dobiti z naknadno uporabo vodika kot goriva. Če pa je mogoče z razvojem tehnologije za pridobivanje jedrske ali sončne energije ustvariti velike in poceni vire energije, se del le-te lahko uporabi za proizvodnjo vodika. Ta vodik se lahko nato uporabi kot priročen nosilec energije. Gospodarsko je bolj donosno prevažati vodik po obstoječih plinovodih kot prenašati električno energijo; vodik je primeren tako za transport kot za shranjevanje. Ker se sodobna industrijska tehnologija opira na gorljiva goriva, bi lahko vodik nadomestil nafto in zemeljski plin, ko se ta goriva izčrpajo in podražijo.
1.8 Poraba energije: trendi in obeti
Najvišja povprečna dnevna poraba energije na prebivalca na svetu pade na in ZDA znaša približno 1,3∙10 6 kJ. Ta količina energije je približno 100-krat večja od naših energetskih potreb v hrani. Poraba energije vsako leto narašča, kot je prikazano na sl. 1.6. Trenutno skoraj 30% letnega
hidroelektrarne in nekaj več kot 2% - jedrske elektrarne. Največja težava pri uporabi fosilnih goriv je, da jih bomo sčasoma popolnoma izčrpali. Pri tem se bomo morali zanašati na vse dražje vire teh goriv.
VIRI ENERGIJE PRIHODNOSTI
Po nekaterih ocenah naj bi do konca 20. stoletja obstoječe zaloge nafte in zemeljskega plina popolnoma izčrpane, razen če se pojavijo drugi viri energije ali se ne zmanjša njena poraba na prebivalca. To določa velik interes za ustvarjanje novih virov energije. Trenutno se veliko truda usmerja v raziskovanje možnosti uporabe jedrske in sončne energije ter v razvoj načinov učinkovitejše rabe premoga. Zanimanje je tudi za uporabo geotermalne energije (toplotne energije, ki prihaja iz zemeljskega nedra), energije vetra in plimovanja morja. Strokovnjaki predvidevajo, da lahko vsak od teh treh energentov prispeva majhen, a pomemben prispevek k celotni energetski bilanci, na splošno pa v doglednem času ne bodo imeli odločilnega vpliva, zato jih ne bomo podrobneje obravnavali. Tu se bomo le na kratko zadržali na problemih rabe premoga in sončne energije.
Zaloge premoga presegajo zaloge vseh drugih fosilnih goriv; predstavlja 80 % zalog fosilnih goriv v ZDA in 90 % po vsem svetu. Vendar pa se pri uporabi premoga sooča s številnimi težavami. Od vseh goriv premog povzroča največ onesnaženja zraka. Njegova proizvodnja je pogosto draga in nevarna. nahajališča premoga se lahko nahajajo daleč od območij njegove porabe; na primer v Združenih državah se večina neizkoriščenih bogatih nahajališč premoga nahaja v zahodnem delu države, porabniki energije pa so koncentrirani večinoma ob vzhodni obali; prevoz premoga na dolge razdalje dodatno poveča njegove stroške. Nekateri strokovnjaki trdijo, da bi se premog lahko uporabljal učinkoviteje, če bi ga spremenili v plin, ki se imenuje sintetični plin (»syngas«). Postopek pretvorbe lahko odstrani žveplo iz premoga, kar naj bi zmanjšalo onesnaževanje zraka med poznejšim zgorevanjem sintetičnega plina. Syngas je enostaven za transport po ceveh in lahko dopolni naše vse manjše zaloge zemeljskega plina. Uplinjanje premoga zahteva dodajanje vodika. Za to se premog zdrobi v prah, ki ga obdelamo s pregreto paro. Izdelek vsebuje mešanico CO, H 2 in CH 4 in vse te snovi se lahko uporabljajo kot goriva. Vendar so pogoji postopka izbrani tako, da se doseže največji izkoristek CH 4 . Poenostavljen diagram najpomembnejših reakcij, ki se pojavljajo v tem procesu, je prikazan na sl. 1.7.
Sončna energija je največji vir energije na svetu. Sončna energija, ki pade na samo 0,1 % kopenskega območja ZDA, je enaka vsej energiji, ki se trenutno porabi v ZDA. Težava pri izrabi sončne energije je v tem, da je zelo razpršena, časovno nedosledna in odvisna od vremenskih razmer. Naprave, ki pretvarjajo sončno energijo v električno energijo, trenutno še niso dovolj učinkovite. Eden od možne načine Uporaba sončne energije je ustvarjanje "energetskih nasadov". Takšni nasadi lahko hitro pridelajo velike pridelke različnih rastlin, nato pa te rastline sežgejo za energijo. Sončna energija trenutno lahko služi kot pomoč za ogrevanje stanovanj skupaj s tradicionalnimi; uporaba sončnih grelnikov vode ter premišljena razporeditev sten in oken hiš pripomore k ustvarjanju in vzdrževanju zahtevane temperature v stanovanjih.
Za zaključek razprave ugotavljamo, da je bil naš glavni poudarek na preprečevanju energetske krize z ustvarjanjem novih virov energije.
Vendar pa je k rešitvi tega problema mogoče pristopiti z druge strani – z zmanjšanjem ravni porabe energije na prebivalca in neproduktivnih stroškov energije. Ta način varčevanja z energijo je morda najbolj smiseln izhod.
PONOVITE MATERIAL